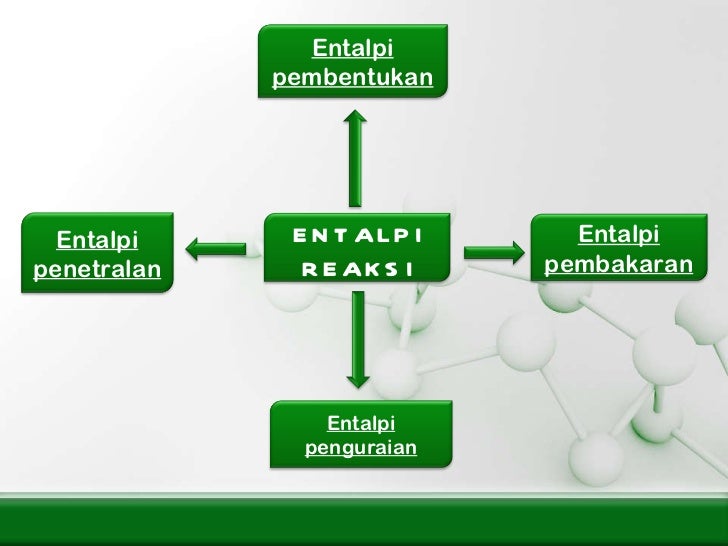
Jenis Jenis Perubahan Entalpi Standar. Misalnya, pembakaran karbon atau grafit. Untuk dapat membandingkan harga dari berbagai perubahan entalpi, maka dibuat suatu keadaan standar tertentu. Koefisien senyawa c 2 h 2 adalah 2, ini berarti c 2 h 2 adalah 2 mol, maka semua koefisien reaksi dibagi 2 termasuk δh f reaksi menjadi: Entalpi standar perubahan kimia meliputi entalpi pembentukan standar, entalpi penguraian standar, entalpi atomisasi standar, entalpi pembakaran standar, entalpi netralisasi standar, entalpi larutan standar dan entalpi reaksi standar.

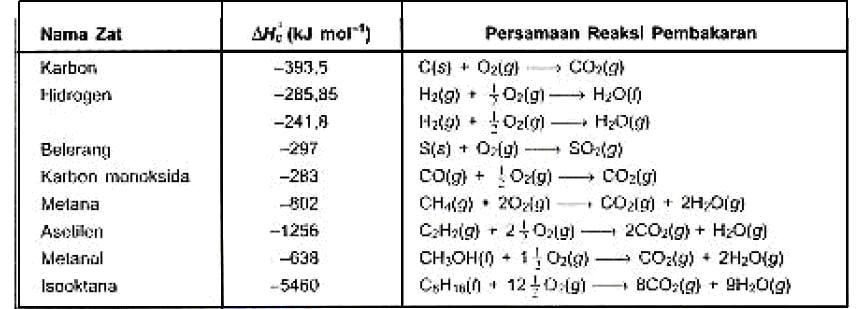
Entalpi pembakaran standar (∆hc° = standard enthalpy of combustion) entalpi pembakaran standar adalah perubahan entalpi (∆h) untuk pembakaran sempurna 1 mol senyawa atau unsur dengan o2 dari udara, yang diukur pada 298 k dan tekanan 1 atm. Perubahan entalpi standar dibagi berdasarkan perubahan kimianya menjadi reaksi pembentukan, penguraian, pembakaran, dan netralisasi. Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang dh saja. Misalnya, pembakaran karbon atau grafit. Satuannya adalah kj / mol. Contoh perubahan entalpi pembentukan standar gas karbon dioksida.
Perubahan entalpi yang diukur pada suhu 25 o c dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda dh o atau dh 298).;
Satuannya adalah kj / mol. C (s) + o 2 (g) → co 2 (g) δhf o = +110,5 kj. Berdasarkan jenis reaksi yang terjadi, perubahan entalpi dibedakan menjadi: Yang perlu diingat dari perubahan entalpi adalah kesesuaiannya dengan hukum kekekalan energi. Δh°sub h 2 o (s) = +46,1 kj/mol. Koefisien senyawa c 2 h 2 adalah 2, ini berarti c 2 h 2 adalah 2 mol, maka semua koefisien reaksi dibagi 2 termasuk δh f reaksi menjadi:
 Source: natsu2.blogspot.com
Source: natsu2.blogspot.com
Entalpi jenis ini dilengkapi dengan huruf f, yang dibentuk. Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang dh saja. Jika tidak diukur pada keadaan standar, perubahan entalpi pembentukan dinotasikan δh° f. Sub = sublimation / sublimasi. Banyak reaksi yang dapat berlangsung secara bertahap.

Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap). Entalpi reaksi (hr) entalpi reaksi adalah jenis entalpi yang paling umum dan paling sering digunakan, karena entalpi ini adalah panas yang dapat mengalami perubahan kimia. Perubahan entalpi standar dibagi berdasarkan perubahan kimianya menjadi reaksi pembentukan, penguraian, pembakaran, dan netralisasi. Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang dh saja. Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap).
 Source: slideshare.net
Source: slideshare.net
Entalpi standar perubahan kimia meliputi entalpi pembentukan standar, entalpi penguraian standar, entalpi atomisasi standar, entalpi pembakaran standar, entalpi netralisasi standar, entalpi larutan standar dan entalpi reaksi standar. Perubahan entalpi yang diukur pada suhu 25 o c dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda dh o atau dh 298).; Entalpi perubahan kimia biasanya ditentukan pada keadaan standar, sehingga sering disebut entalpi standar. Misalnya, pembakaran karbon atau grafit. Perubahan entalpi yang diukur pada suhu 25 o c dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda dh o atau dh 298).
 Source: slideshare.net
Source: slideshare.net
Contoh perubahan entalpi pembentukan standar gas karbon dioksida. Entalpi molar = perubahan entalpi tiap mol zat ( kj / mol ). Entalpi perubahan kimia biasanya ditentukan pada keadaan standar, sehingga sering disebut entalpi standar. Koefisien senyawa c 2 h 2 adalah 2, ini berarti c 2 h 2 adalah 2 mol, maka semua koefisien reaksi dibagi 2 termasuk δh f reaksi menjadi: Yang perlu diingat dari perubahan entalpi adalah kesesuaiannya dengan hukum kekekalan energi.
 Source: youtube.com
Source: youtube.com
Entalpi reaksi (hr) entalpi reaksi adalah jenis entalpi yang paling umum dan paling sering digunakan, karena entalpi ini adalah panas yang dapat mengalami perubahan kimia. Entalpi perubahan kimia biasanya ditentukan pada keadaan standar, sehingga sering disebut entalpi standar. Dengan definisinya dimana entalpi terlibat dalam perubahan kimia, maka hal itu menyebabkan entalpi ini dapat terjadi dalam beberapa jenis perubahan tersebut. Entalpi molar = perubahan entalpi tiap mol zat ( kj. Dari persamaan (6.9) diketahui bahwa δh juga dapat dihitung jika diketahui entalpi yang sebenarnya untuk semua reaktan dan produk.
 Source: youtube.com
Source: youtube.com
Berikut ini adalah beberapa jenis entalpi yang ada saat ini. 6.6 entalpi reaksi dan entalpi pembentukan standar. Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap). C (s) + o 2 (g) → co 2 (g) δhf o = +110,5 kj. Untuk lebih dipahami kita jabarkan yuk!
 Source: youtube.com
Source: youtube.com
Entalpi sublimasi h 2 o; Banyak reaksi yang dapat berlangsung secara bertahap. Berdasarkan jenis reaksi yang terjadi, perubahan entalpi dibedakan menjadi: Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang dh saja.; Entalpi reaksi (hr) entalpi reaksi adalah jenis entalpi yang paling umum dan paling sering digunakan, karena entalpi ini adalah panas yang dapat mengalami perubahan kimia.
 Source: slideshare.net
Source: slideshare.net
Berikut ini adalah beberapa jenis entalpi yang ada saat ini. Perubahan entalpi standar dibagi berdasarkan perubahan kimianya menjadi reaksi pembentukan, penguraian, pembakaran, dan netralisasi. Untuk dapat membandingkan harga dari berbagai perubahan entalpi, maka dibuat suatu keadaan standar tertentu. Contoh perubahan entalpi pembentukan standar gas karbon dioksida. Entalpi reaksi (hr) entalpi reaksi adalah jenis entalpi yang paling umum dan paling sering digunakan, karena entalpi ini adalah panas yang dapat mengalami perubahan kimia.

6.6 entalpi reaksi dan entalpi pembentukan standar. Entalpi molar = perubahan entalpi tiap mol zat ( kj / mol ). Koefisien senyawa c 2 h 2 adalah 2, ini berarti c 2 h 2 adalah 2 mol, maka semua koefisien reaksi dibagi 2 termasuk δh f reaksi menjadi: Entalpi perubahan kimia biasanya ditentukan pada keadaan standar, sehingga sering disebut entalpi standar. Entalpinya bisa dilepaskan maupun diserap.
 Source: slideshare.net
Source: slideshare.net
Misalnya, pembakaran karbon atau grafit. Δh°sub h 2 o (s) = +46,1 kj/mol. Perubahan entalpi standar dibagi berdasarkan perubahan kimianya menjadi reaksi pembentukan, penguraian, pembakaran, dan netralisasi. Entalpi reaksi (hr) entalpi reaksi adalah jenis entalpi yang paling umum dan paling sering digunakan, karena entalpi ini adalah panas yang dapat mengalami perubahan kimia. Untuk dapat membandingkan harga dari berbagai perubahan entalpi, maka dibuat suatu keadaan standar tertentu.
 Source: ruangguru.com
C (s) + o 2 (g) → co 2 (g) δhf o = +110,5 kj. Perubahan entalpi yang diukur pada suhu 25 o c dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda dh o atau dh 298). Berikut ini adalah beberapa jenis entalpi yang ada saat ini. Jika tidak diukur pada keadaan standar, perubahan entalpi pembentukan dinotasikan δh° f. Dengan definisinya dimana entalpi terlibat dalam perubahan kimia, maka hal itu menyebabkan entalpi ini dapat terjadi dalam beberapa jenis perubahan tersebut.

Contoh perubahan entalpi pembentukan standar gas karbon dioksida. Jika tidak diukur pada keadaan standar, perubahan entalpi pembentukan dinotasikan δh° f. Reaksi yang disebutkan dalam entalpi ini adalah reaksi umum, hingga tidak spesifik dalam sebuah jenis reaksi. Perubahan entalpi sublimasi standar (δh° sub) perubahan entalpi sublimasi standar adalah perubahan entalpi pada perubahan 1 mol zat dalam fase padat menjadi gas pada keadaan standar (25 °c, 1 atm). Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap).
 Source: dokumen.tips
Source: dokumen.tips
C (s) + o 2 (g) → co 2 (g) δhf o = +110,5 kj. Jika tidak diukur pada keadaan standar, perubahan entalpi pembentukan dinotasikan δh° f. Entalpi molar = perubahan entalpi tiap mol zat ( kj / mol ). Misalnya, pembakaran karbon atau grafit. Koefisien senyawa c 2 h 2 adalah 2, ini berarti c 2 h 2 adalah 2 mol, maka semua koefisien reaksi dibagi 2 termasuk δh f reaksi menjadi:

Sub = sublimation / sublimasi. Entalpi molar = perubahan entalpi tiap mol zat ( kj. Entalpi perubahan kimia biasanya ditentukan pada keadaan standar, sehingga sering disebut entalpi standar. Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang dh saja.; Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang dh saja.
 Source: slideshare.net
Source: slideshare.net
Entalpi molar = perubahan entalpi tiap mol zat ( kj / mol… Untuk lebih dipahami kita jabarkan yuk! Entalpi pembakaran standar (∆hc° = standard enthalpy of combustion) entalpi pembakaran standar adalah perubahan entalpi (∆h) untuk pembakaran sempurna 1 mol senyawa atau unsur dengan o2 dari udara, yang diukur pada 298 k dan tekanan 1 atm. Entalpi perubahan kimia biasanya ditentukan pada keadaan standar, sehingga sering disebut entalpi standar. Entalpi molar = perubahan entalpi tiap mol zat ( kj.
 Source: youtube.com
Source: youtube.com
Perubahan entalpi sublimasi standar (δh° sub) perubahan entalpi sublimasi standar adalah perubahan entalpi pada perubahan 1 mol zat dalam fase padat menjadi gas pada keadaan standar (25 °c, 1 atm). Entalpi sublimasi h 2 o; Perubahan entalpi yang diukur pada suhu 25 o c dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda dh o atau dh 298). Koefisien senyawa c 2 h 2 adalah 2, ini berarti c 2 h 2 adalah 2 mol, maka semua koefisien reaksi dibagi 2 termasuk δh f reaksi menjadi: Dalam kimia, jenis perubahan kimia itu akan mempengaruhi jenis entalpi yang terlibat didalamnya.
 Source: kimia-science7.com
Source: kimia-science7.com
Entalpi reaksi (hr) entalpi reaksi adalah jenis entalpi yang paling umum dan paling sering digunakan, karena entalpi ini adalah panas yang dapat mengalami perubahan kimia. Satuannya adalah kj / mol. Agar kita dapat mengenal semua jenis perubahan entail, saya akan paparkan pengertian semua jenis perubahan entalpi sebagai berikut : Banyak reaksi yang dapat berlangsung secara bertahap. Jika karbon dibakar dengan oksigen berlebihan terbentuk karbondioksida menurut persamaan reaksi :
 Source: blog.ruangguru.com
Entalpi molar = perubahan entalpi tiap mol zat ( kj / mol ). Untuk lebih dipahami kita jabarkan yuk! Perubahan entalpi standar dibagi berdasarkan perubahan kimianya menjadi reaksi pembentukan, penguraian, pembakaran, dan netralisasi. Berikut ini adalah beberapa jenis entalpi yang ada saat ini. Dalam kimia, jenis perubahan kimia itu akan mempengaruhi jenis entalpi yang terlibat didalamnya.
This site is an open community for users to share their favorite wallpapers on the internet, all images or pictures in this website are for personal wallpaper use only, it is stricly prohibited to use this wallpaper for commercial purposes, if you are the author and find this image is shared without your permission, please kindly raise a DMCA report to Us.
If you find this site adventageous, please support us by sharing this posts to your preference social media accounts like Facebook, Instagram and so on or you can also save this blog page with the title jenis jenis perubahan entalpi standar by using Ctrl + D for devices a laptop with a Windows operating system or Command + D for laptops with an Apple operating system. If you use a smartphone, you can also use the drawer menu of the browser you are using. Whether it’s a Windows, Mac, iOS or Android operating system, you will still be able to bookmark this website.






